Gefässerkrankungen der unteren Extremitäten
Unser Ziel ist es, die molekularbiologischen Mechanismen zu erforschen, die zur Entstehung von peripheren Aneurysmen im Zusammenhang mit der pAVK führen.
Sie verläuft meist asymptomatisch, nur etwa 1 – 2% der Patientinnen und Patienten entwickeln eine kritische Extremitätenischämie. Diese Patienten und Patientinnen leiden häufiger an einer koronaren Herzkrankheit und/oder einer anderen Erkrankung der Gefässe. Weiterhin sind stenotische oder aneurysmatische Läsionen der Aortenbifurkation in mehr als 95% aller Fälle die Ursache für PAVK [Fowkes 2013].
Unsere Ergebnisse zeigten, dass sich atherosklerotische Läsionen und deren Progression in den unteren Extremitäten ähnlich verhalten, wie in Carotisarterien [Zimmermann 2015]. Folglich können auch in peripheren Gefässen vulnerable Plaques entstehen, die zum Schlaganfall oder Herzinfarkt führen können.
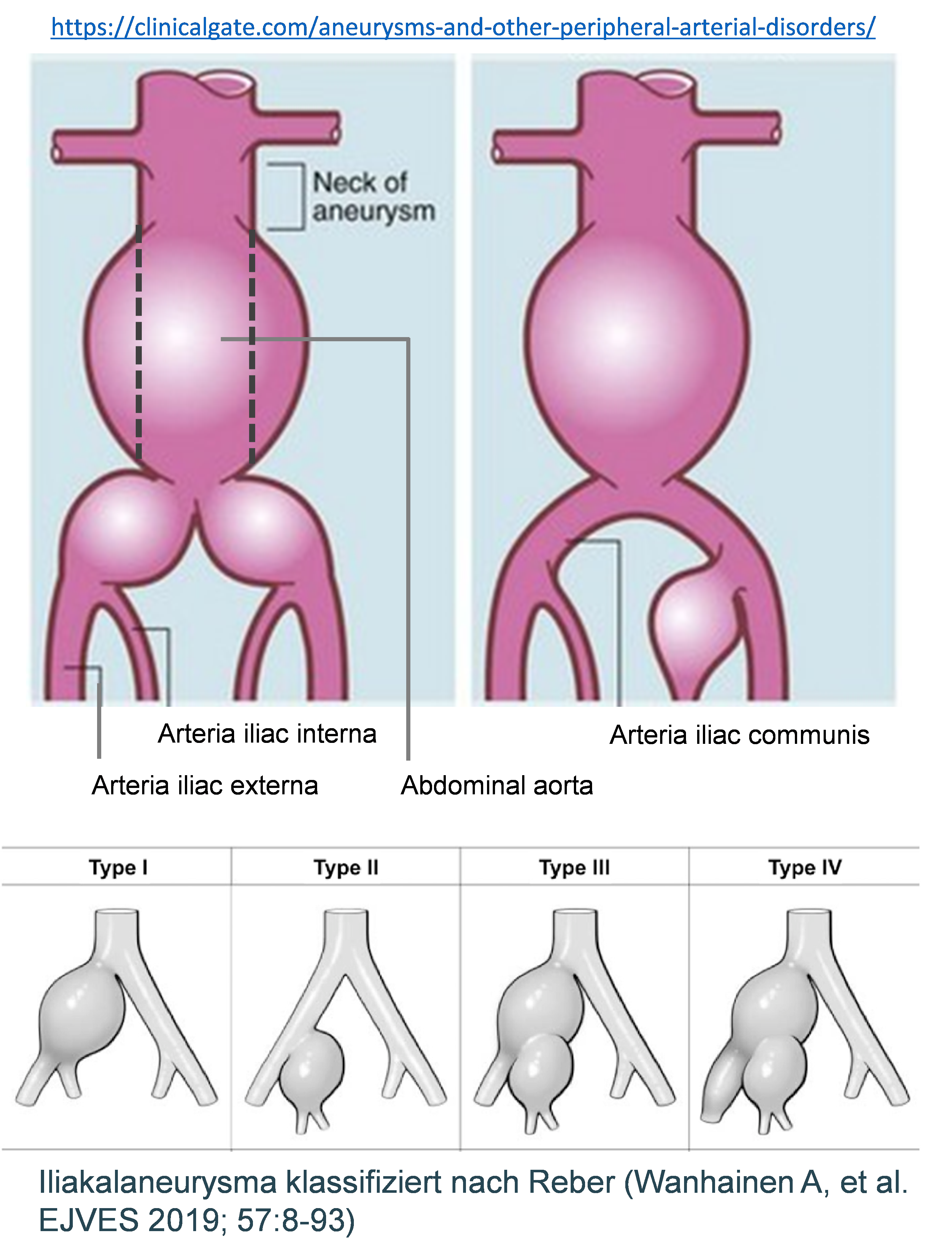
Aneurysma kommt nicht nur in Aorta vor, sondern auch in peripheren Gefässen, insbesondere in männlichen Individuen über 70 Jahre. In den meisten Fällen (70%) werden dabei Femoral- oder Iliakalarterien getroffen (FA, IA). In 25% der Fälle gehen periphere Aneurysmen mit abdominellen Aortenaneurysmen (AAA) einher, was das Krankheitsbild erschwert und das Risiko weiterer Komplikationen massgeblich erhöht.
Daher fokussieren wir uns insbesondere auf Patienten und Patientinnen mit komplexen Aneurysmen mitsamt AAA und Femoral/Iliakalaneurysmen. Unser Ziel ist die molekular-biologische Mechanismen zu ergründen, die zur Entstehung von Aneurysmen in den unteren Extremitäten führen, im Zusammenhang mit bereits bestehender PAVK. Weiterhin vergleichen wir die Prozesse und Veränderungen in der Gefässwand zwischen AAA und FA/IA, um bestehende Unterschiede zu ermitteln.
Dazu bedienen wir uns wiederum der neuesten Techniken wie Proteomics, Transkriptomics und scRNA-Sequencing. Dafür werden unter anderem glatte Muskelzellen (SMCs) und Endothelzellen (ECs), isoliert aus den betroffenen Patienten und Patientinnen, analysiert.
- Fowkes FG, et al. Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: a systematic review and analysis. Lancet. 2013;382(9901):1329-40.
- Wildgruber M, Aschenbrenner T, Wendorff H, Czubba M, Glinzer A, Haller B, Schiemann M, Zimmermann A, Berger H, Eckstein HH, Meier R, Wohlgemuth WA, Libby P, Zernecke A. The „Intermediate“ CD14++CD16+ monocyte subset increases in severe peripheral artery disease in humans. Sci Rep. 2016;6:39483.
- Rasper M, Wildgruber M, Settles M, Eckstein HH, Zimmermann A, Reeps C, Rummeny EJ, Huber AM. 3D non-contrast-enhanced ECG-gated MR angiography of the lower extremities with dual-source radiofrequency transmission at 3.0T: Intraindividual comparison with contrast-enhanced MR angiography in PAOD patients. Eur Radiol. 2016;26(9):2871-80.
- Zimmermann A, Senner S, Eckstein HH, Pelisek J. Histomorphological evaluation of atherosclerotic lesions in patients with peripheral artery occlusive disease. Adv Med Sci. 2015;60(2):236-9.
- Zimmermann A, Wendorff H, Schuster T, Auer F, Berger H, Eckstein HH. Interobserver agreement of the TASC II classification for supra- and infrainguinal lesions. Eur J Vasc Endovasc Surg. 2010;39:586-90.