Kontakt
Gerne geben wir Ihnen nähere Auskunft! Rufen Sie uns unverbindlich an oder schreiben Sie eine E-Mail.
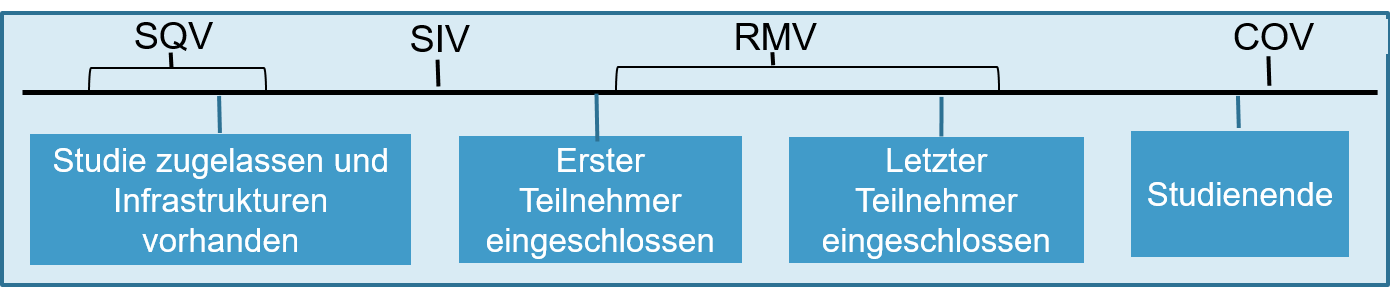
Das Monitoring besteht aus zielgerichteten Qualitätskontrollen in klinischen Studien und Forschungsprojekten inklusive der Prozessoptimierung.
Das Monitoring unterstützt den Sponsor dabei die Studie zu überwachen, zu steuern, und falls nötig korrigierende Massnahmen zu implementieren. Das Ziel der durchgeführten Qualitätskontrolle ist der Schutz der Teilnehmenden und die Qualität der Daten. Ein schriftlicher Bericht nach den Visiten informiert über den Fortschritt der Studie, allfällige Mängel und gibt Empfehlungen zu deren Behebung.
Umfang und Art der Monitoring -Aktivitäten variieren je nach Risiko-Kategorie, weiteren Sicherheitsüberlegungen und der Komplexität der Studie.
Gerne geben wir Ihnen nähere Auskunft! Rufen Sie uns unverbindlich an oder schreiben Sie eine E-Mail.
Sie möchten selber als Monitor/-in tätig werden? Besuchen Sie unsere Weiterbildung zum klinischen Monitor/-in!